Grafyt, molekulêre formule: C, molekulêre gewicht: 12,01, is in foarm fan elemint koalstof, elk koalstofatom is ferbûn troch trije oare koalstofatomen (arrangearre yn honeycomb-hexagonen) om in kovalent molekule te foarmjen.Om't elk koalstofatom in elektroan útstjit, dyjingen dy't frij kinne bewege, dus grafyt is in dirigint.
Grafyt is ien fan 'e sêftste mineralen, en har gebrûk omfettet it meitsjen fan potleadliedingen en smeermiddelen.Koalstof is in net-metallysk elemint yn 'e twadde syklus IVA-groep fan it periodyk systeem.Grafyt wurdt foarme by hege temperatueren.
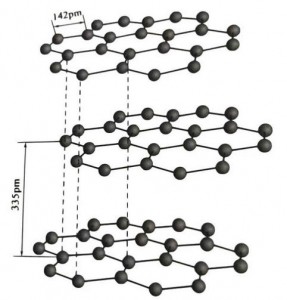
Grafyt is in kristallijn mineraal fan koalstofeleminten, en har kristalline rooster is in hexagonale laachstruktuer.De ôfstân tusken elke gaaslaach is 3.35A, en de ôfstân fan koalstofatomen yn deselde gaaslaach is 1.42A.It is in hexagonaal kristalsysteem mei in folsleine laach cleavage.De cleavage oerflak is benammen molekulêre obligaasjes, minder oantreklik foar molekulen, dus syn natuerlike float is hiel goed.
Yn grafytkristallen foarmje de koalstofatomen yn deselde laach in kovalente bân mei sp2-hybridisaasje, en elk koalstofatom is ferbûn mei trije oare atomen yn trije kovalente obligaasjes.De seis koalstofatomen foarmje in seis trochgeande ring yn itselde fleantúch, dy't útwreidet yn in lamellastruktuer, wêrby't de bânlingte fan 'e CC-bân 142pm is, wat krekt binnen it bânlingteberik fan it atomyske kristal is, dus foar deselde laach , it is in atomysk kristal.Koalstofatomen yn itselde flak hawwe ien p-baan, dy't inoar oerlappe.Elektronen binne relatyf frij, lykweardich oan frije elektroanen yn metalen, dus grafyt kin waarmte en elektrisiteit liede, wat it karakteristyk is fan metalen kristallen.Sa ek klassifisearre as metallyske kristallen.
De middelste laach fan grafyt kristal wurdt skieden troch 335pm, en de ôfstân is grut.It wurdt kombinearre mei van der Waals krêft, dat is, de laach heart by de molekulêre kristal.Om't de bining fan koalstofatomen yn deselde flaklaach lykwols tige sterk is en ekstreem lestich te ferneatigjen is, is it ûntbiningspunt fan grafyt ek tige heech en binne de gemyske eigenskippen stabyl.
Mei it each op syn spesjale bonding modus, kin net wurde beskôge as ien kristal of polycrystal, grafyt wurdt no algemien beskôge as in mingd kristal.
Post tiid: Jul-31-2023